曾工致力于各类电子电器产品的国际国内认证、EMC整改,欢迎各位询价,提供专业服务,解决客户痛点!专治各种产品不合格!
电话:139 2899 3907 邮箱:info@emc.wiki
“FDA”的版本间差异
(创建页面,内容为“==FDA注册查询== ===输入以下网址=== https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm ===输入公司的英文名=== 在Establishment or Trade…”) |
|||
| (未显示同一用户的39个中间版本) | |||
| 第1行: | 第1行: | ||
==FDA简介== | |||
美国食品药品监督管理局(英语:U.S. Food and Drug Administration,缩写为FDA)为美国卫生与公众服务部直辖的联邦政府机构,其主要职能为负责对美国国内生产及进口的食品、膳食补充剂、药品、疫苗、生物医药制剂、血液制剂、医疗设备、放射性设备、兽药和化妆品进行监督管理,同时也负责执行公共健康法案(the Public Health Service Act)的第361号条款,包括公共卫生条件及州际旅行和运输的检查、对于诸多产品中可能存在的疾病的控制等等。 | |||
==FDA注册查询== | ==FDA注册查询== | ||
=== | ===FDA查询网址=== | ||
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm | https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm | ||
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/pmn.cfm | |||
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm | |||
====判定FDA注册信息的有效==== | |||
1、信息要一致。 | |||
首先注册的Owner/Operator Name、Owner/Operator Number、Registration Number 这几个基本信息,与你要采购的产品信息厂家要对的上,或者你自己注册的信息,与你自己真实的公司信息要对的上。 | |||
2、产品类别要准确。 | |||
例如额温枪,电子体温计等<font color="red">产品就是2类产品,你偏偏要做1类注册来搞</font> ,你说这个注册下来有没效,是否符合法规呢?虽然,做1类注册列名非常快速也简单。但是不符合法律法规的也是不行的,迟早不抓。 | |||
3、适用的法律法规的技术标准文件要正确。 | |||
<font color="red">每个类别的产品,都有适用的产品类别,适用的产品类别后面,都有适用的FDA法规编号标准要求</font>,以及适用的性能标准,技术标准与要求,必须要准确无误。 | |||
===输入公司的英文名=== | ===输入公司的英文名=== | ||
| 第7行: | 第24行: | ||
[[文件:Establishment Registration & Device Listing.jpg|659x720px|无框]] | [[文件:Establishment Registration & Device Listing.jpg|659x720px|无框]] | ||
===名词与术语解释=== | |||
进入FDA认证注册码查询页面后: | |||
'''Owner/Operator Name''': FDA证书内产权人名称,是企业名称和产品名称信息查询方式,这一栏是输入认证企业英文名称来查询的。 | |||
'''Owner/Operator Number''': 证书内产权人识别号,所有者的FDA编号。利用注册码号码来查询注册企业信息的,这一栏输入企业注册码,即可查询到注册企业信息。 | |||
'''Registration Number''' :这一栏输入510K注册码或产品注册码,就可查询注册企业信息。 | |||
'''Registration Number''' :不是k号,一般510k号是有带k的号码。 | |||
'''Regulation Number''' : <font color="red">'''是该类产品注册时,适用的法规,点进去后就知道这个产品定义与描述,大概是什么,以及适用的法规类别,到底是做几类?'''</font> | |||
[[文件:Regulation Number - 880.2900.jpg|977x547px|无框]] | |||
'''Device Class''' : 这个是1就是1类产品,是2就是2类产品。1类列名可以很便宜注册,2类就比较复杂,周期长,或者选510k豁免类别与方法。 | |||
'''Product Code''' : 点进去就可以知道当前这个产品,是按照什么产品类别做的,然后可以得到法规编号Regulation Number,还有产品等级Device Class是几类的。 | |||
'''Recognized Consensus Standard''': 适用的标准,公认共识标准,符合的技术要求。 | |||
'''Establishment Registration & Device Listing''' : 机构注册和产品或设备清单,<font color="red">'''注意如下黄色部分是法规限定的类别,基本这个黄色区域就是最权威的,然后破折号-后面的都是厂家自定义的名称、描述、型号,很多都是以假乱真,例如明明是普通接触式电子体温计类别,后面非要写一个红外非接触式体温计。'''</font> | |||
[[文件:Establishment Registration & Device Listing - Result.jpg|979x586px|无框]] | |||
===注意=== | |||
# 因为反恐原因,美国FDA法案明确要求,食品企业包括普通食品和罐头食品、食品接触材料生产企业, 即使在美国FDA官网进行了注册,也无法查询,也不允许查询。所以所有食品企业和食品接触材料企业的注册信息在FDA官网均不能查询。需要查询的,可以利用注册时的用户ID和密码登录查看。 | |||
# 有Registration Number产品注册码的,不一定是k号,必须带有k的才是正儿八经的510k注册。 | |||
# 其他三类fda查询都需要发邮件,发件地址如下: | |||
* 化妆品查询邮箱E-mail: vcrp@fda.gov | |||
* 食品注册查询邮箱e-mail: webmail@oc.fda.gov | |||
* 激光注册查询邮箱e-mail: cdrhesub@cdrh.fda.gov | |||
化妆品、食品、激光FDA查询注意事项,此收件箱是美国FDA认证机构邮箱,文字必须是英文,一般2到3周FDA官方会给予回复! | |||
==FDA列名和注册== | ==FDA列名和注册== | ||
| 第22行: | 第73行: | ||
* 上市前通知(PMN或俗称510k) | * 上市前通知(PMN或俗称510k) | ||
* 上市前批准(PMA) | * 上市前批准(PMA) | ||
==FDA医疗器械分类== | ==FDA医疗器械分类== | ||
| 第33行: | 第83行: | ||
===Ⅲ类产品=== | ===Ⅲ类产品=== | ||
Ⅲ类产品(占7%左右),III类产品为“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。三类产品实施的是上市前许可,企业须向FDA递交PMA(Premarket Application)申请(小部分Ⅲ类产品可以走510k)。 | Ⅲ类产品(占7%左右),III类产品为“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。三类产品实施的是上市前许可,企业须向FDA递交PMA(Premarket Application)申请(小部分Ⅲ类产品可以走510k)。 | ||
==FDA证书== | |||
我们常见的“FDA证书”其实是咨询公司自己制作的,是发给客户用来说明FDA注册信息的文件而已,并非FDA官方发布的医疗器械注册证!做得好的咨询公司会在此“证书”上注明“此证书并非FDA发布,本公司也非FDA附属机构”。只是很多客户看不懂,误以为这是FDA证书。当然也有一些不法机构冒充FDA给企业发证。 | |||
那么,如何判断一款产品是否在FDA上市呢?很简单,上FDA官网查询! | |||
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm | |||
===FDA官方公告=== | |||
[[文件:FDA notice.jpg|671x936px|无框]] | |||
在这份官方公告中,FDA指出: | |||
1,FDA不会向医疗器械企业颁发注册证书 | |||
* FDA does not issue Registration Certificates to medical device establishments. | |||
2,不会对已经注册或者列名的产品或企业出具确认证书。 | |||
* FDA does not certify registration and listing information for firms that have registered and listed. | |||
3,企业注册和产品列名信息并不代表FDA批准了该企业和其产品。 | |||
* Registration and Listing does not denote approval or clearance of a firm or their devices. | |||
====公告网址==== | |||
https://www.fda.gov/medical-devices/how-study-and-market-your-device/device-registration-and-listing | |||
==510k== | |||
[[510k]] | |||
https://www.iec.wiki/html/510k | |||
==常见问题== | |||
* 问题一:FDA证书是哪个机构发放的? | |||
答:FDA注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。 | |||
FDA在此时发布这样一则通告可谓是强提醒!由于近期美国疫情的发展,医用防疫用品出口美国的需求量大量增加,出口注册需求也就增多,但是存在一些企业冒充FDA给厂家颁发证书,一些经销企业在咨询厂家的时候,拿到的“FDA证书”也可能是假冒的。 | |||
* 问题二:FDA需要指定的认证实验室检测吗? | |||
答:FDA是一个执法机构,而不是服务机构。如果有人说他们是FDA下属的认证实验室,那么他至少是在误导消费者,因为FDA既没有面向公众的服务性认证机构与实验室,也没有所谓的“指定实验室”。 | |||
FDA作为联邦执法机构,不可以从事这种既当裁判又当运动员的事。FDA只会对服务性的检测实验室的GMP质量进行认可,合格的颁发合格证书,但不会向公众“指定”,或推荐特定的一家或几家。 | |||
* 问题三:FDA注册是否一定需要一位美国代理人? | |||
答:是的,企业在进行FDA注册时必须指派一名美国公民(公司/社团)作为其代理人,该名代理人负责进行位于美国的过程服务,是联系FDA与申请人的媒介。 | |||
==FDA注册的常见误区== | |||
(1)FDA注册和CE认证不同,他认证的模式不同于CE认证的产品检测+报告证书模式,'''FDA注册实际上采用的是诚信宣告模式''',即:你对自己的产品符合相关标准和安全要求负责,并在美国联邦网站注册,如果产品出事,那么就要承担相应的责任。因此FDA注册对于大部分产品,不存在寄样品检测和出证书的说法。 | |||
(2)FDA注册有效期问题:'''FDA注册有效期为一年''',如果超过一年,则需要重新提交注册,所涉及的年费也需要重新付。 | |||
(3)FDA注册是否有证书? | |||
实际上,'''FDA注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说'''。我们通常看到的这个证书是中介代理机构(注册代理)签发给厂家,以证明其帮助该厂家完成了美国FDA要求的“生产设施注册和产品类型注册”(Establishment Registration and Device Listing),完成的标志是帮助厂家取得了FDA的注册登记号。 | |||
==FDA官方网站== | |||
https://www.fda.gov/ | |||
2023年5月19日 (五) 11:53的最新版本
FDA简介
美国食品药品监督管理局(英语:U.S. Food and Drug Administration,缩写为FDA)为美国卫生与公众服务部直辖的联邦政府机构,其主要职能为负责对美国国内生产及进口的食品、膳食补充剂、药品、疫苗、生物医药制剂、血液制剂、医疗设备、放射性设备、兽药和化妆品进行监督管理,同时也负责执行公共健康法案(the Public Health Service Act)的第361号条款,包括公共卫生条件及州际旅行和运输的检查、对于诸多产品中可能存在的疾病的控制等等。
FDA注册查询
FDA查询网址
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpmn/pmn.cfm
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm
判定FDA注册信息的有效
1、信息要一致。 首先注册的Owner/Operator Name、Owner/Operator Number、Registration Number 这几个基本信息,与你要采购的产品信息厂家要对的上,或者你自己注册的信息,与你自己真实的公司信息要对的上。
2、产品类别要准确。 例如额温枪,电子体温计等产品就是2类产品,你偏偏要做1类注册来搞 ,你说这个注册下来有没效,是否符合法规呢?虽然,做1类注册列名非常快速也简单。但是不符合法律法规的也是不行的,迟早不抓。
3、适用的法律法规的技术标准文件要正确。 每个类别的产品,都有适用的产品类别,适用的产品类别后面,都有适用的FDA法规编号标准要求,以及适用的性能标准,技术标准与要求,必须要准确无误。
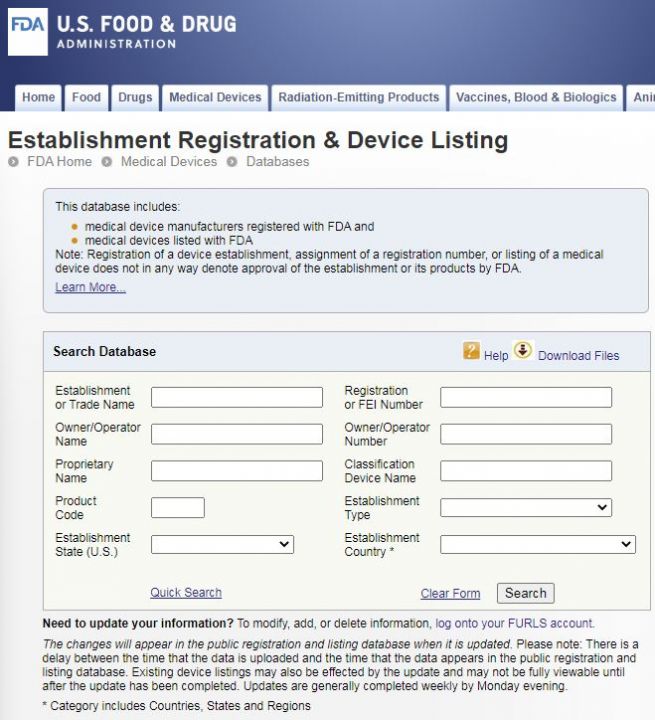
输入公司的英文名
在Establishment or Trade Name一栏输入你想查询的公司的英文名,点击Search即可。
名词与术语解释
进入FDA认证注册码查询页面后:
Owner/Operator Name: FDA证书内产权人名称,是企业名称和产品名称信息查询方式,这一栏是输入认证企业英文名称来查询的。
Owner/Operator Number: 证书内产权人识别号,所有者的FDA编号。利用注册码号码来查询注册企业信息的,这一栏输入企业注册码,即可查询到注册企业信息。
Registration Number :这一栏输入510K注册码或产品注册码,就可查询注册企业信息。
Registration Number :不是k号,一般510k号是有带k的号码。
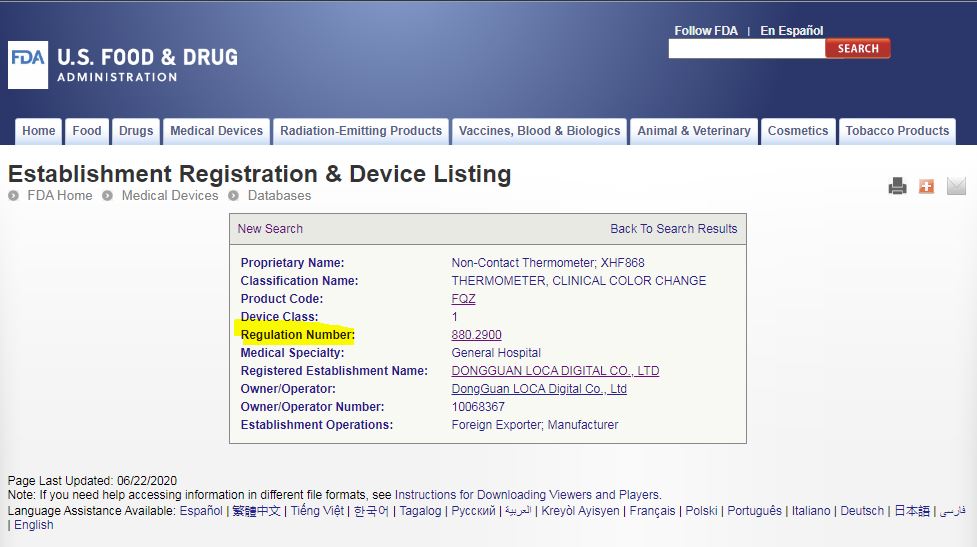
Regulation Number : 是该类产品注册时,适用的法规,点进去后就知道这个产品定义与描述,大概是什么,以及适用的法规类别,到底是做几类?
Device Class : 这个是1就是1类产品,是2就是2类产品。1类列名可以很便宜注册,2类就比较复杂,周期长,或者选510k豁免类别与方法。
Product Code : 点进去就可以知道当前这个产品,是按照什么产品类别做的,然后可以得到法规编号Regulation Number,还有产品等级Device Class是几类的。
Recognized Consensus Standard: 适用的标准,公认共识标准,符合的技术要求。
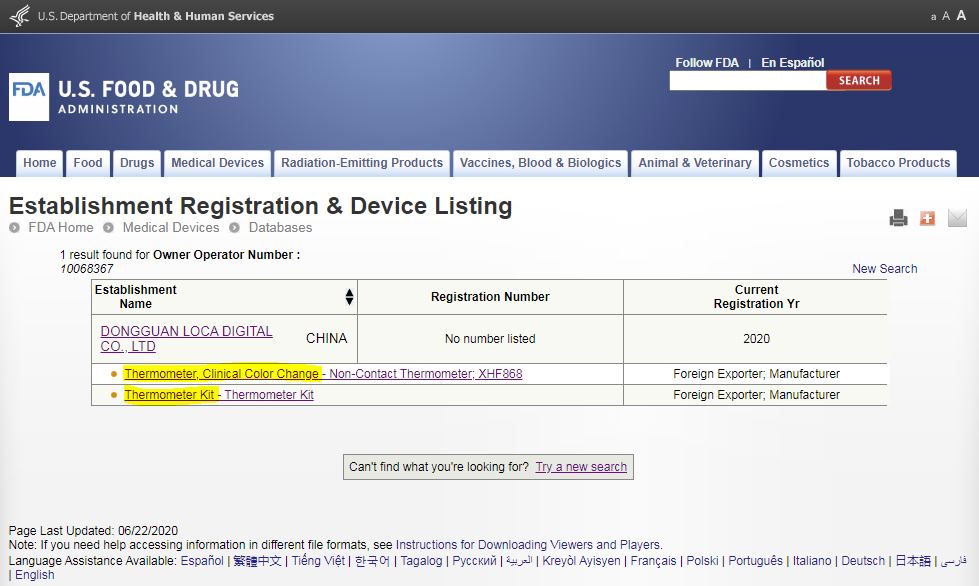
Establishment Registration & Device Listing : 机构注册和产品或设备清单,注意如下黄色部分是法规限定的类别,基本这个黄色区域就是最权威的,然后破折号-后面的都是厂家自定义的名称、描述、型号,很多都是以假乱真,例如明明是普通接触式电子体温计类别,后面非要写一个红外非接触式体温计。
注意
- 因为反恐原因,美国FDA法案明确要求,食品企业包括普通食品和罐头食品、食品接触材料生产企业, 即使在美国FDA官网进行了注册,也无法查询,也不允许查询。所以所有食品企业和食品接触材料企业的注册信息在FDA官网均不能查询。需要查询的,可以利用注册时的用户ID和密码登录查看。
- 有Registration Number产品注册码的,不一定是k号,必须带有k的才是正儿八经的510k注册。
- 其他三类fda查询都需要发邮件,发件地址如下:
- 化妆品查询邮箱E-mail: vcrp@fda.gov
- 食品注册查询邮箱e-mail: webmail@oc.fda.gov
- 激光注册查询邮箱e-mail: cdrhesub@cdrh.fda.gov
化妆品、食品、激光FDA查询注意事项,此收件箱是美国FDA认证机构邮箱,文字必须是英文,一般2到3周FDA官方会给予回复!
FDA列名和注册
很多朋友搞不清楚列名和注册的区别,其实列名就相当于登记备案,适用于I类器械和小部分低风险的II类器械。而注册是包括技术审评的,适用于大部分II类器械和III类器械。列名很简单,企业或者咨询公司在网上就能操作,而注册则需要向FDA递交资料并经过审评。
- 列名
相当于登记备案,适用于I类器械和小部分低风险的II类器械。
- 注册
包括技术审评,适用于大部分II类器械和III类器械。
FDA注册分类
简单说,医疗器械在美国FDA上市有三条路:列名、上市前通知(PMN或俗称510k)和上市前批准(PMA)。FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ),其中Ⅲ类器械风险等级最高。
- 列名
- 上市前通知(PMN或俗称510k)
- 上市前批准(PMA)
FDA医疗器械分类
Ⅰ类产品
Ⅰ类产品(占47%左右),I类产品为“普通管理”产品,是指风险小或无风险的产品。如医用手套、压舌板、手动手术器械等,实行的是一般控制(General Control),绝大部分产品只需进行企业注册和产品列名即可进入美国市场;
Ⅱ类产品
Ⅱ类产品(占46%左右),II类产品为“上市前通知(Pre-market Notification)”产品,企业在进行工厂注册后还须递交510k申请(证明拟注册产品和FDA以往批准过的产品在预期用途和技术特性上是等同的)并经过FDA技术评审。注意:部分低风险的II类器械是510k豁免,只需进行列名即可。FDA评审通过后会签发一个510k通知信;
Ⅲ类产品
Ⅲ类产品(占7%左右),III类产品为“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。三类产品实施的是上市前许可,企业须向FDA递交PMA(Premarket Application)申请(小部分Ⅲ类产品可以走510k)。
FDA证书
我们常见的“FDA证书”其实是咨询公司自己制作的,是发给客户用来说明FDA注册信息的文件而已,并非FDA官方发布的医疗器械注册证!做得好的咨询公司会在此“证书”上注明“此证书并非FDA发布,本公司也非FDA附属机构”。只是很多客户看不懂,误以为这是FDA证书。当然也有一些不法机构冒充FDA给企业发证。
那么,如何判断一款产品是否在FDA上市呢?很简单,上FDA官网查询!
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
FDA官方公告
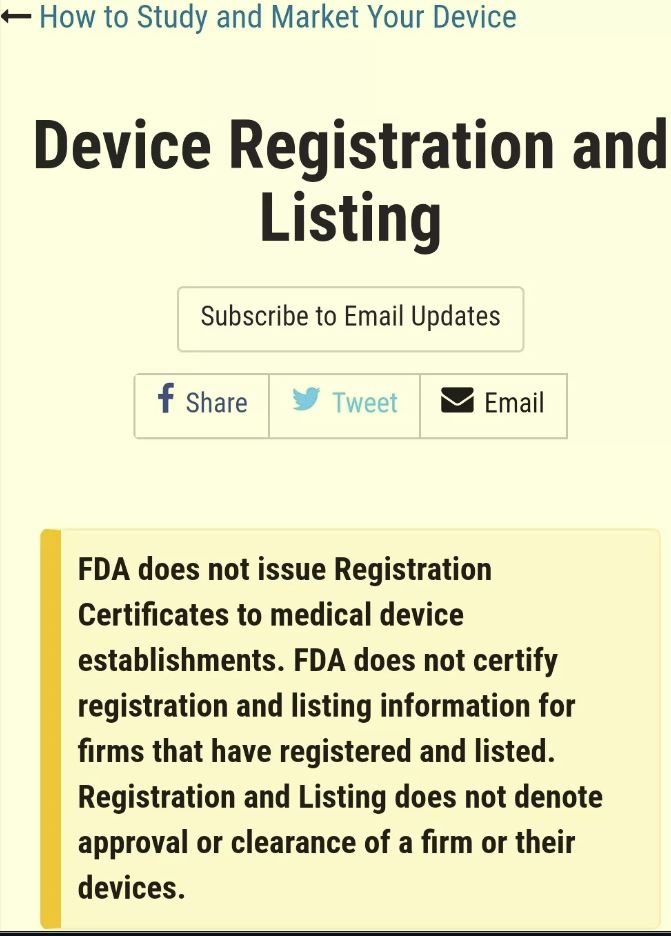
在这份官方公告中,FDA指出:
1,FDA不会向医疗器械企业颁发注册证书
- FDA does not issue Registration Certificates to medical device establishments.
2,不会对已经注册或者列名的产品或企业出具确认证书。
- FDA does not certify registration and listing information for firms that have registered and listed.
3,企业注册和产品列名信息并不代表FDA批准了该企业和其产品。
- Registration and Listing does not denote approval or clearance of a firm or their devices.
公告网址
https://www.fda.gov/medical-devices/how-study-and-market-your-device/device-registration-and-listing
510k
https://www.iec.wiki/html/510k
常见问题
- 问题一:FDA证书是哪个机构发放的?
答:FDA注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。
FDA在此时发布这样一则通告可谓是强提醒!由于近期美国疫情的发展,医用防疫用品出口美国的需求量大量增加,出口注册需求也就增多,但是存在一些企业冒充FDA给厂家颁发证书,一些经销企业在咨询厂家的时候,拿到的“FDA证书”也可能是假冒的。
- 问题二:FDA需要指定的认证实验室检测吗?
答:FDA是一个执法机构,而不是服务机构。如果有人说他们是FDA下属的认证实验室,那么他至少是在误导消费者,因为FDA既没有面向公众的服务性认证机构与实验室,也没有所谓的“指定实验室”。
FDA作为联邦执法机构,不可以从事这种既当裁判又当运动员的事。FDA只会对服务性的检测实验室的GMP质量进行认可,合格的颁发合格证书,但不会向公众“指定”,或推荐特定的一家或几家。
- 问题三:FDA注册是否一定需要一位美国代理人?
答:是的,企业在进行FDA注册时必须指派一名美国公民(公司/社团)作为其代理人,该名代理人负责进行位于美国的过程服务,是联系FDA与申请人的媒介。
FDA注册的常见误区
(1)FDA注册和CE认证不同,他认证的模式不同于CE认证的产品检测+报告证书模式,FDA注册实际上采用的是诚信宣告模式,即:你对自己的产品符合相关标准和安全要求负责,并在美国联邦网站注册,如果产品出事,那么就要承担相应的责任。因此FDA注册对于大部分产品,不存在寄样品检测和出证书的说法。
(2)FDA注册有效期问题:FDA注册有效期为一年,如果超过一年,则需要重新提交注册,所涉及的年费也需要重新付。
(3)FDA注册是否有证书?
实际上,FDA注册是没有证书的,产品通过在FDA进行注册,将取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。我们通常看到的这个证书是中介代理机构(注册代理)签发给厂家,以证明其帮助该厂家完成了美国FDA要求的“生产设施注册和产品类型注册”(Establishment Registration and Device Listing),完成的标志是帮助厂家取得了FDA的注册登记号。