曾工致力于各类电子电器产品的国际国内认证、EMC整改,欢迎各位询价,提供专业服务,解决客户痛点!专治各种产品不合格!
电话:139 2899 3907 邮箱:info@emc.wiki
FDA
FDA注册查询
输入以下网址
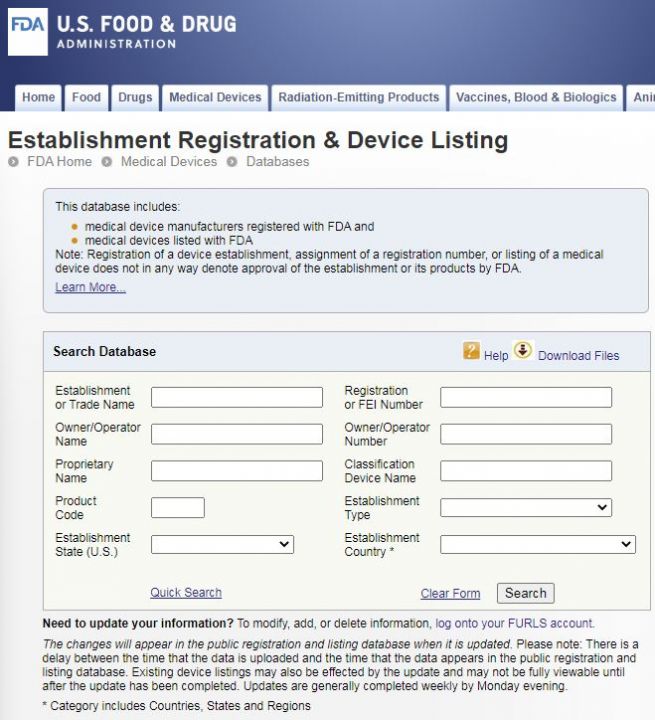
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
输入公司的英文名
在Establishment or Trade Name一栏输入你想查询的公司的英文名,点击Search即可。
FDA列名和注册
很多朋友搞不清楚列名和注册的区别,其实列名就相当于登记备案,适用于I类器械和小部分低风险的II类器械。而注册是包括技术审评的,适用于大部分II类器械和III类器械。列名很简单,企业或者咨询公司在网上就能操作,而注册则需要向FDA递交资料并经过审评。
- 列名
相当于登记备案,适用于I类器械和小部分低风险的II类器械。
- 注册
包括技术审评,适用于大部分II类器械和III类器械。
FDA注册分类
简单说,医疗器械在美国FDA上市有三条路:列名、上市前通知(PMN或俗称510k)和上市前批准(PMA)。FDA将医疗器械分为三类(Ⅰ,Ⅱ,Ⅲ),其中Ⅲ类器械风险等级最高。
- 列名
- 上市前通知(PMN或俗称510k)
- 上市前批准(PMA)
FDA医疗器械分类
Ⅰ类产品
Ⅰ类产品(占47%左右),I类产品为“普通管理”产品,是指风险小或无风险的产品。如医用手套、压舌板、手动手术器械等,实行的是一般控制(General Control),绝大部分产品只需进行企业注册和产品列名即可进入美国市场;
Ⅱ类产品
Ⅱ类产品(占46%左右),II类产品为“上市前通知(Pre-market Notification)”产品,企业在进行工厂注册后还须递交510k申请(证明拟注册产品和FDA以往批准过的产品在预期用途和技术特性上是等同的)并经过FDA技术评审。注意:部分低风险的II类器械是510k豁免,只需进行列名即可。FDA评审通过后会签发一个510k通知信;
Ⅲ类产品
Ⅲ类产品(占7%左右),III类产品为“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等。三类产品实施的是上市前许可,企业须向FDA递交PMA(Premarket Application)申请(小部分Ⅲ类产品可以走510k)。