曾工致力于各类电子电器产品的国际国内认证、EMC整改,欢迎各位询价,提供专业服务,解决客户痛点!专治各种产品不合格!
电话:139 2899 3907 邮箱:info@emc.wiki
Mask Certification
来自认证百科
口罩认证
欧盟口罩认证
- 欧盟个人防护口罩(非医疗器械)
- 欧盟医用口罩(医疗器械)
北美口罩认证
- 美国FDA注册医用口罩
- 美国NIOSH认证防护口罩
欧盟个人防护口罩PPE指令(非医疗器械)
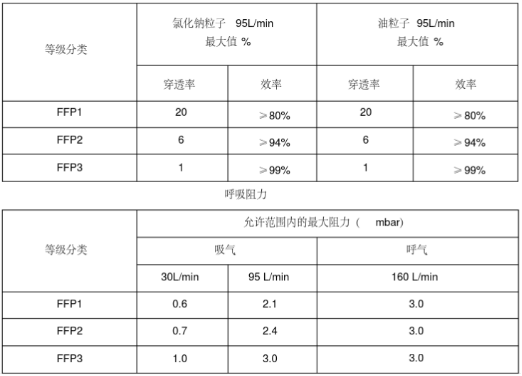
欧盟个人防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。
主流的防护口罩为FFP2/FFP3两大类。
认证流程
1. 产品的型式试验报告
2. 技术文件评审
3. 工厂质量体系审查
4. 颁发CE证书
5. 产品出口
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
欧盟医用口罩新版MDR指令(医疗器械)
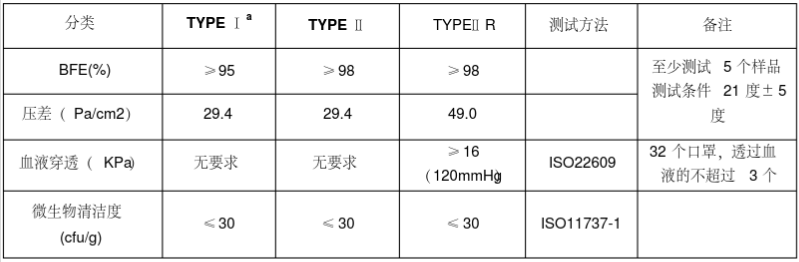
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。
非无菌口罩(现阶段只有这种可行)
1)编制技术文件 2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告) 3)提供符合性声明 4)指定欧盟授权代表完成欧洲注册 时间估计:2-3个月
无菌口罩(现阶段新版MDR实施难度很大)
1)灭菌确认 2)ISO13485体系认证 3)编制技术文件 4)提供测试报告(生物学、性能、无菌等测试报告) 5)公告机构审核(目前几乎没有公告机构愿意接单) 6)获得CE证书 7)指定欧盟授权代表完成欧洲注册 时间估计:1-2年,因此今年几乎是不可能了!
检测标准
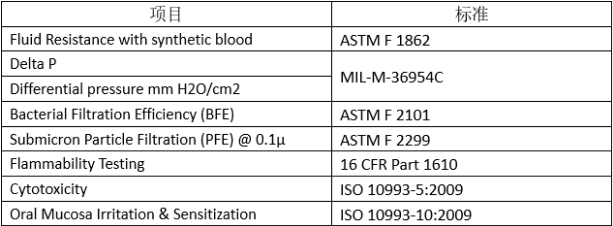
1)生物学评价:ISO10993-1,ISO10993-5,ISO10993-10(常规三项) 2)细菌过滤效率:EN 14683:2019附录B 3)呼吸阻抗:EN 14683:2019的附录C 4)防溅阻力:ISO 22609:2004 5)生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个)
美国FDA注册医用口罩(医疗器械)
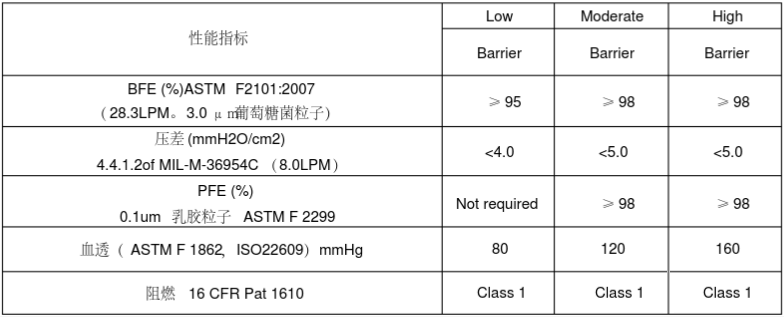
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ儿科口罩和OUK带抗菌/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。
510k申请流程
1)进行产品测试(性能测试、生物学测试)
2)准备510k技术文件,提交FDA审评
3)获得FDA的510k批准信
4)完成工厂注册和器械列名
时间估计:6-10个月
注意:如已从官方途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k